Учеба и наука
Решено
Массовая доля щелочного металла в его оксиде равна 83%. Оксид массой 18,8г растворили в 81,2мл воды. - определить металл. - Написать уравнение - вопрос №2647030
реакции. — Вычислить массовую долю растворенного вещества в полученном растворе
ноябрь 5, 2017 г.
-
Всего ответов: 2
-
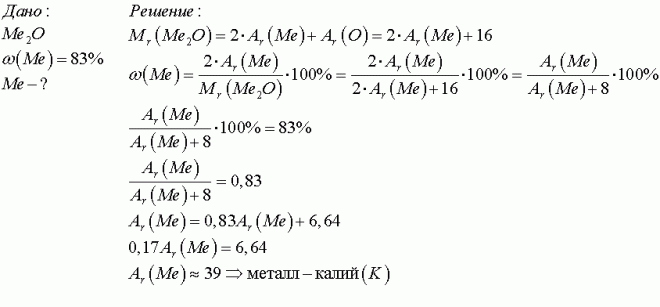
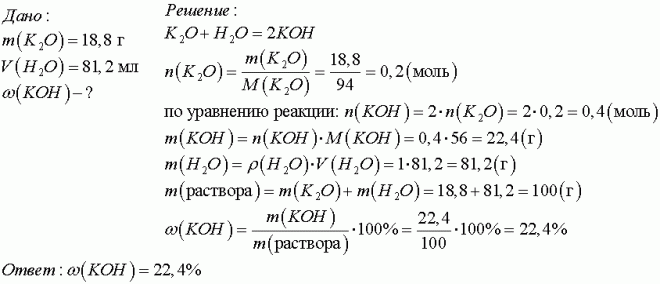 Лучший ответ по мнению автора
Лучший ответ по мнению автора -
По условию ω(металла) в оксиде = 83%
тогда ω(O) в оксиде = 100 — 83 = 17%
При этом Мэкв(O) = 8 г/моль
тогда найдем Мэкв(металла) по закону эквивалентов:
Мэкв(металла) = 83*8/17 = 39 г/моль
Т.к. у щелочных металлов валентность = 1, то атомная масса металла = 39*1=39 а.е.м. Это калий.
K2O + H2O → 2KOH
n(K2O) = 18,8/94 = 0,2 моль
m(K2O) = 0,2*94 = 18,8 г
K2O в недостатке, вода в избытке, поэтому рассчитываем кол-во образующегося KOH по кол-ву K2O (т.е. по недостатку).
Образуется по уравнению реакции 0,2*2 = 0,4 моль KOH
m(KOH) = 0,4*56 = 22,4 г
m(раствора) = m(K2O) + m(H2O) = 18,8 + 81,2 = 100 г
ω(KOH) = m(KOH)*100/m(раствора) = 22,4*100 / 100 = 22,4 %
Похожие вопросы
http://pixs.ru/showimage/10638jpg_8717069_14466280.jpg http://pixs.ru/showimage/11638jpg_4139996_14466295.jpg...
октябрь 27, 2014 г.
Массовая доля углерода в соединении равна 83.3%, водорода - 16.7%. Определите строение вещества, если известно, что при его бромировании образуется только одно монобромпроизводное.
октябрь 29, 2015 г.
Решено
вычислите константу и степень гидролиза 0,01 н. раствора нитрата аммония
апрель 1, 2014 г.


