Учеба и наука
Вычислить pH буферного раствора, состоящего... - вопрос №516546
Вычислить pH буферного раствора, состоящего из 4мл 0,2М раствор CH3COOH и 6 мл 0,2 М раствора CH3COONa. Константа электрической диссоциации уксусной кислоты равна 1,85 10(5 степени)
январь 9, 2013 г.
-
Всего ответов: 1
-
Яндекс, запрос «рН буферного раствора». Первая ссылка — Вики:
Значение pH буферного раствора можно рассчитать по формуле:
![\mbox{pH=pK+}\lg\frac{[A^-]}{[HA]}](http://upload.wikimedia.org/math/b/4/3/b431c3b88d402fce4d80f0412de32bd7.png) , где
, где 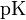 это отрицательный десятичный логарифм от константы диссоциации кислоты
это отрицательный десятичный логарифм от константы диссоциации кислоты  .
.По сути
![\mbox{pH=}\lg\frac{[A^-]}{K[HA]}](http://upload.wikimedia.org/math/f/8/6/f86b663d24df631b120999af7b6a67da.png) .
.Видим, что рН связан с К и отношением концентрации соли к концентрации кислоты.
Внимательно рассмотрев условие задачи, видим, что это отношение в данном буферном растворе равно 6:4.
Поэтому рН = рК + lg(3/2).
Остальное — арифметика.
Удачи!
Похожие вопросы
1). Как изменяются неметаллические свойства химических элементов в ряду: кремний —-— фосфор —--— сера —--— хлор? 2). Составьте уравнения химических...
Вопрос задан анонимно май 16, 2014 г.
Решено
При сгорании 20 мл горючего газа расходуется 50 мл кислорода и получается 40 мл оксида углерода(4) и 20 мл водяных паров. Найдите формулу газа.
январь 19, 2013 г.
Вычислите массовую долю элементов в этиловом спирте.(подробное решение)
октябрь 14, 2010 г.

