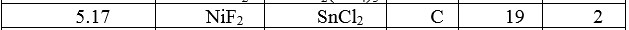Учеба и наука
-
Всего ответов: 1
-
Задание 1.
К: Ni(2+) + 2e = Ni(0)
А: 2F(-) — 2e = F2(0)
NiF2 —(↯)→ Ni + F2
Задание 2.
Угольные электроды — инертные электроды.
K(-) C | SnCl2, H2O | C A(+)
В растворе находятся:SnCl2 → Sn2+ + 2Сl–Н2О
На инертном катоде восстанавливается олово и вода:K: Sn2+ + 2ē → Sn |1
2H2O + 2e → H2 + 2OH(-) |1На инертном аноде выделяется хлор:А: 2Cl(–) – 2ē → Cl2↑ |2__________________________________Sn(2+) + 2Cl(–) + 2Н2О → Sn↓ + 2Cl2↑ + H2 + 2OH(-)
2SnCl2 + 2H2O —(↯)→ Sn↓ + 2Cl2↑ + H2 + Sn(OH)2Схема: А инерт. (+) | SnCl2 (водн. р-р) | К инерт. (–)
По закону Фарадея:
m = M• I •t/(z•F),где m – масса выделившегося на электроде вещества, F – число Фарадея, равное 96 485 А•с/моль, или 26,8 А•ч/моль, М – молярная масса элемента, восстанавливающегося в процессе электролиза, t – время проведения процесса электролиза (в секундах или часах), I – сила тока (в амперах), z – число электронов, участвующих в процессе.
m(Sn) = 119 * 2 * 19/(2*26.8) = 84,37 грамм
n(Sn) = 84,37/119 = 0,71 моль
n(Sn) = n(H2) = n(Sn(OH)2) = 0,71 моль
n(Cl2) = 2*0,71 = 1,42 моль
V(Cl2) = 1,42*22,4 = 31,81 л
V(H2) = 0,71*22,4 = 15,904 л
m(Sn(OH)2) = 153*0,71 = 108,63 граммЛучший ответ по мнению автора
Похожие вопросы
В каком году была сформулирована теория - предшественница кислородной теории горения.
июль 16, 2015 г.
Учеба и наука